В настоящее время сведения об эпидемиологии, клинических особенностях, профилактике и лечении этого заболевания ограничены. Известно, что наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является двусторонняя пневмония, у 3 - 4% пациентов зарегистрировано развитие острого респираторного дистресс-синдрома (ОРДС).
Рекомендации, представленные в документе, в значительной степени базируются на материалах по диагностике, профилактике и лечению COVID‑19, опубликованных специалистами ВОЗ, китайского, американского и европейского центров по контролю за заболеваемостью, анализе отечественных и зарубежных научных публикаций, нормативно-правовых документах Минздрава России и Роспотребнадзора.
Методические рекомендации предназначены для руководителей медицинских организаций и их структурных подразделений, врачей-терапевтов, врачей общей практики, врачей-инфекционистов, врачей-педиатров, врачей - акушеров-гинекологов, врачей-реаниматологов отделений интенсивной терапии инфекционных стационаров, врачей скорой медицинской помощи, а также иных специалистов, работающих в сфере организации оказания медицинской помощи пациентам с COVID‑19.
В приложениях приводятся в числе прочего:
- рекомендуемая экспресс-форма описания результатов КТ грудной клетки пациента с подозрением на COVID‑пневмонию;
- инструкция по проведению этиологической лабораторной диагностики коронавирусной инфекции, к этиологической диагностике отнесено не только выявление РНК вируса, но также антител IgM и IgG к вирусу, несмотря на отсутствие для этого доказательной базы, что признано в тексте рекомендаций;
- лабораторные маркёры при мониторинге COVID-19 и их интерпретация;
- перечень зарегистрированных в РФ диагностических наборов реагентов для выявления РНК SARS-CoV‑2 (по состоянию на 26.05.2020);
- зарегистрированные в РФ диагностические наборы реагентов для выявления иммуноглобулинов к SARS-CoV‑2 (по состоянию на 26.05.2020);
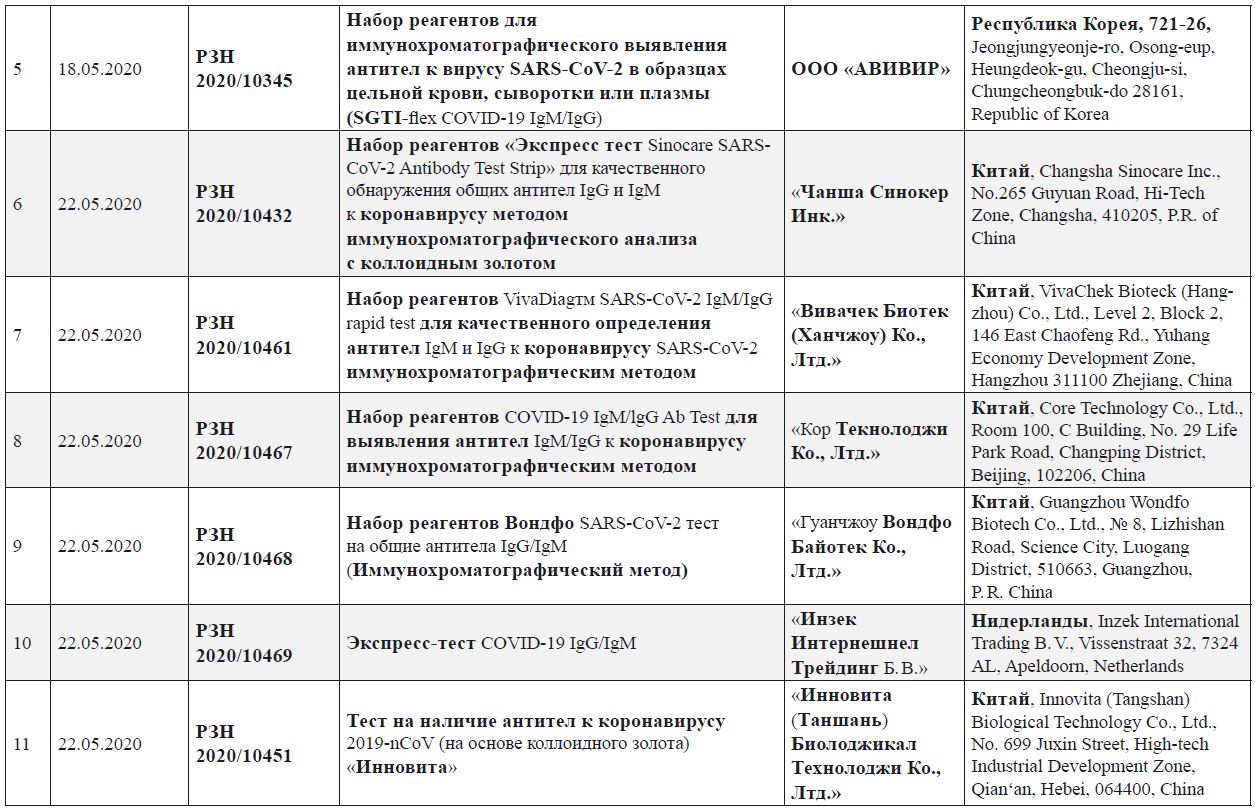
- зарегистрированные в РФ экспресс-тесты для выявления иммуноглобулинов к SARS-CoV‑2 (по состоянию на 26.05.2020);
- лекарственные препараты, которые запрещено или не желательно принимать с этиотропной терапией COVID-19;
- список возможных к назначению лекарственных средств для лечения COVID‑19 у взрослых;
- рекомендованные схемы лечения в зависимости от тяжести заболевания.
"Временные методические рекомендации "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 7 (03.06.2020)" (утв. Минздравом России)
http://www.consultant.ru/law/hotdocs/62760.html
© КонсультантПлюс, 1997-2020
ЛАБОРАТОРНАЯ ДИАГНОСТИКА COVID-19 В 7 ВЕРСИИ МЕТОДИЧЕСКИХ РЕКОМЕНДАЦИЙ МЗ РФ
1. Лабораторная диагностика этиологическая:
• Выявление РНК SARS-CoV‑2 с применением методов амплификации нуклеиновых кислот
(информация представлена в разделе 4.2). Инструкция по проведению этиологической ла‑
бораторной диагностики коронавирусной инфекции представлена в Приложении 3.
• Выявление иммуноглобулинов класса M и класса G к SARS-CoV‑2.
2. Лабораторная диагностика общая (дополнительная):
Объем, сроки и кратность лабораторных исследований зависят от степени тяжести заболе‑
вания. Легкое течение заболевания с наблюдением пациента в амбулаторных условиях не требу‑
ет дополнительных лабораторных исследований. В случае госпитализации по поводу среднетя‑
желого, тяжелого и крайне тяжелого течения необходимо выполнить следующие исследования:
Общий (клинический) анализ крови с определением уровня эритроцитов, гемоглобина,
гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы.
Биохимический анализ крови (мочевина, креатинин, электролиты, глюкоза, аланинами‑
нотрансфераза, аспартатаминотрансфераза, билирубин, альбумин, лактат, лактатдегидрогеназа,
тропонин, ферритин, прокальцитонин, мозговой натрий-уретический пептид – NT‑proBNP/BNP).
Биохимический анализ крови не дает какой-либо специфической информации, но обнаружива‑
емые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопут‑
ствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение,
оказывают влияние на выбор лекарственных средств и/или режим их дозирования.
С‑реактивный белок (СРБ) является основным лабораторным маркером активности
процесса в легких. Его повышение коррелирует с объемом поражения легочной ткани и явля‑
ется основанием для начала противовоспалительной терапии.
Прокальцитонин при коронавирусной инфекции с поражением респираторных отделов
легких находится в пределах референсных значений. Повышение прокальцитонина свидетель‑
ствует о присоединении бактериальной инфекции и коррелирует с тяжестью течения, распро‑
страненностью воспалительной инфильтрации и прогнозом при бактериальных осложнениях.
Коагулограмма в объеме: активированное частичное тромбопластиновое время (АЧТВ),
протромбиновое время (протромбиновое отношение и% протромбина по Квику), фибриноген,
D‑димер (количественным методом).
Прогностические лабораторные маркеры
Лимфопения и тромбоцитопения. У большинства пациентов с COVID‑19 наблюдается
нормальное число лейкоцитов, у одной трети обнаруживается лейкопения; лимфопения при‑
сутствует у 83,2% пациентов. Тромбоцитопения носит умеренный характер, но более отчетли‑
ва среди группы с тяжелым течением и умерших от COVID‑19.
Возрастание D‑димера в 3-4 раза более возрастной нормы и удлинение протромбинового
времени, особенно при тяжелом течении (снижение% протромбина), увеличение фибриногена
имеет клиническое значение. Необходимо учитывать возрастные особенности; D‑димер повыша‑
ется после 50 лет в связи с накоплением хронических заболеваний. Расчет возрастного уровня
верхней границы референтного интервала может быть выполнен по формуле: возраст х 0,01 мкг/мл
(при измерении в единицах FEU). Также с осторожностью нужно подходить к исследованию D‑ди‑
мера у беременных. Для беременности, даже физиологически протекающей, характерно повышение
D‑димера с существенным разбросом значений в этой группе. Вне инфекции SARS-CoV‑2 D‑димер
не является определяющим в тактике и при назначении низкомолекулярных гепаринов. Клиническое
значение его повышения при COVID‑19 у беременных окончательно не определено.
Наличие органной дисфункции, декомпенсации сопутствующих заболеваний и развитие
осложнений, выявленные биохимическим анализом крови, имеют прогностическое значение
и оказывают влияние на выбор лекарственных средств и/или режим их дозирования. Возможно
повышение активности аминотрансфераз и креатинкиназы, концентрации тропонина, креати‑
нина или мочевины;
Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной̆
инфильтрации и прогнозом при пневмонии. Концентрация СРБ увеличивалась у большинства
пациентов, одновременно с увеличением интерлейкина‑6 (ИЛ‑6) и СОЭ в разной степени. ИЛ‑6,
ИЛ‑10 и TNF‑α возрастают во время болезни и снижаются при выздоровлении. Пациенты,
нуждающиеся в госпитализации, имеют значительно более высокие уровни ИЛ‑6, ИЛ‑10 и TNF‑α
и сниженное количество CD4 и CD8 T‑клеток. Уровень ИЛ‑6, ИЛ‑10 и фактора некроза опухо‑
ли-α обратно коррелирует с количеством CD4 и CD8, ассоциированных с лимфопенией. Отме‑
чено увеличение острофазового белка ферритина при неблагоприятном течении заболевания.
Лабораторными признаками «цитокинового шторма» и ОРДС могут быть: внезапное
нарастание клинических проявлений через 1-2 недели от момента начала заболевания, сохра‑
няющаяся или вновь появившаяся фебрильная лихорадка, выраженная лимфопения в общем
анализе крови, снижение количества Т- и В‑лимфоцитов, значительное повышение уровня
D‑димера (>1500) или его быстрое нарастание и/или высокие уровни интерлейкина‑6 (> 40 пг/мл)
и/или повышение уровня С‑реактивного белка более 75 мг/л, интерстициальное поражение
легких. При развитии ОРДС каждые 48-72 часа до стойкого получения отрицательных уровней
необходимо определять: ИЛ‑6, D‑димер, ферритин, фибриноген, C‑реактивный белок, тригли‑
цериды, ЛДГ.
В диагностике и прогнозе течения сепсиса имеет значение уровень прокальцитонина:
< 0.5 мкг/л – низкий риск бактериальной коинфекции и неблагоприятного исхода; > 0.5 мкг/л –
пациенты с высоким риском, вероятна бактериальная коинфекция. Анализ на прокальцитонин
при поступлении является дополнительной информацией для ранней оценки риска и исключе‑
ния бактериальной коинфекции у пациентов с COVID‑19.
Развитие сердечно-сосудистых осложнений при COVID‑2019 также сопровождается
лимфопенией, тромбоцитопенией, повышением СРБ, МВ фракции креатинкиназы, высоко‑
чувствительного тропонина и мозгового натрий-уретического пептида (NT pro-BNP). Для
выявления пациентов группы риска необходимо рассмотреть регулярный контроль тропони‑
на (ежедневно в ОРИТ, через день – у стационарных пациентов), контроль NT‑proBNP как
маркера миокардиального стресса: у пациента с нарастающей одышкой и NT‑proBNP ≥ 2000
пг/мл отмечен наивысший риск и приоритет для очного осмотра и госпитализации в ОРИТ;
при 400 ≤ NT‑proBNP < 2000 пг/мл пациенты рассматривается как больной с промежуточным
риском.
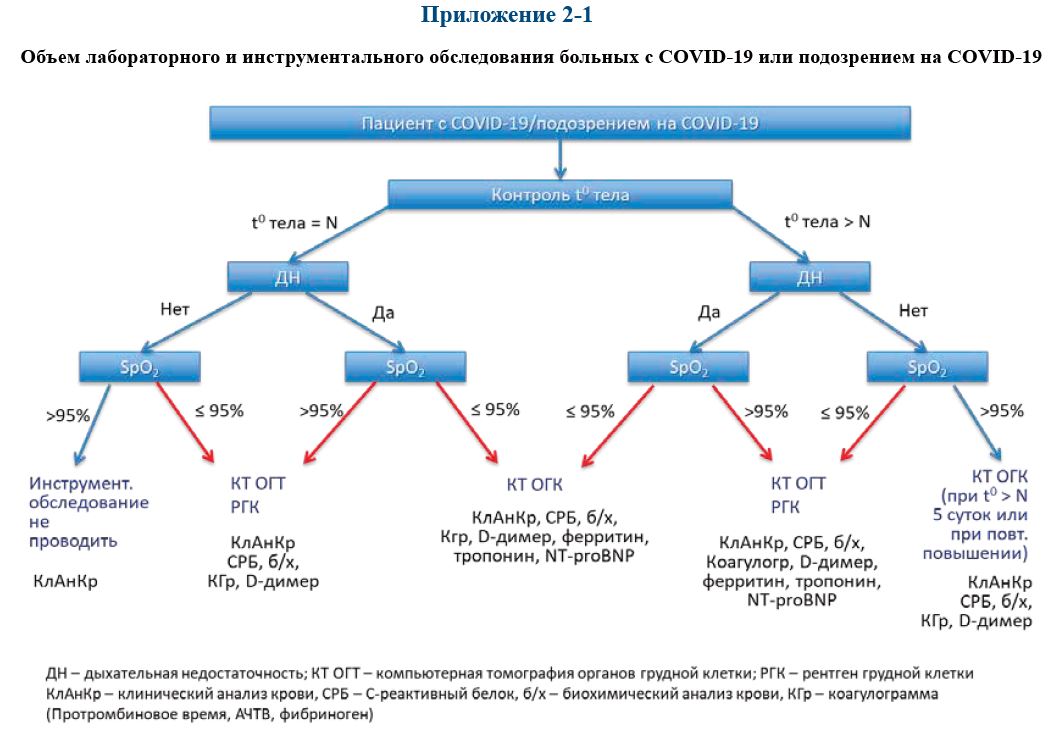
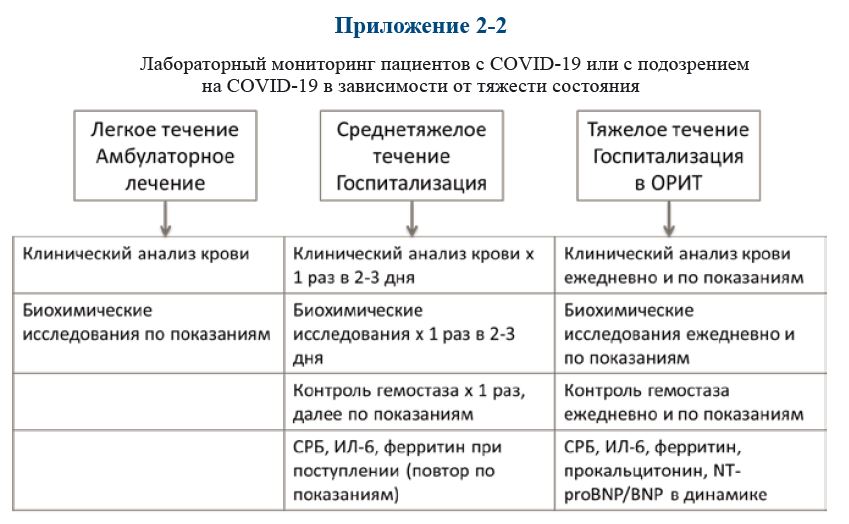
Необходимый объем лабораторного и инструментального обследования в зависимости
от клинических проявлений заболевания представлен в Приложении 2-1. Лабораторный мони‑
торинг пациентов с COVID‑19 или с подозрением на COVID‑19 в зависимости от тяжести со‑
стояния представлен в Приложении 2-2.
Приложение 2.1.
Объем лабораторного и инструментального обследования больных с COVID‑19 или подозрением на COVID‑19
Приложение 2.2.
Лабораторный мониторинг пациентов с COVID‑19 или с подозрением на COVID‑19 в зависимости от тяжести состояния
Приложение 3.
Инструкция по проведению этиологической лабораторной диагностики коронавирусной инфекции
Общие положения
В соответствии с приказом Министерства здравоохранения Российской Федерации № 198н
от 19.03.2020 (в ред. от 27.03.2020 и от 02.04.2020)
и Временными методическими рекомендациями по лабораторной диагностике нового
коронавируса 2019 (2019-COVIDn), утвержденным Главным санитарным врачом Российской
Федерации 30.03.2020, этиологическая лабораторная диагностика коронавирусной инфекции
проводится во всех лабораториях Российской Федерации вне зависимости от их организацион‑
но-правовой формы (далее – Лаборатория), имеющих санитарно-эпидемиологическое заклю‑
чение о возможности проведения работ с возбудителями инфекционных заболеваний человека
III – IV патогенности и условия для исследований с применением методов амплификации нуклеиновых кислот.
Для выявления возбудителя SARS-CoV‑2 используются методы амплификации нуклеи‑
новых кислот (без накопления возбудителя), с применением зарегистрированных в установлен‑
ном порядке на территории Российской Федерации тест-систем, в соответствии с инструкция‑
ми по их применению.
Этиологическая лабораторная диагностика COVID‑19
Этиологическая диагностика COVID‑19 проводится с применением методов амплифика‑
ции РНК с обратной транскрипцией и флуоресцентной детекцией: методами полимеразной
цепной реакции в реальном времени (ОТ ПЦР-РВ) и методами изотермальной амплификации.
Для выявления COVID‑19 исследуются респираторные диагностические материалы, взя‑
тые у пациента: мазки из носоглотки и ротоглотки, мокрота, эндотрахеальный аспират, брон‑
хоальвеолярный лаваж). Могут быть исследованы и другие виды диагностического материала:
кровь (сыворотка, цельная кровь), моча.
Сбор, хранение и транспортировка диагностического материала
Взятие диагностического материала, его упаковка, маркировка и транспортировка осу‑
ществляется в соответствии с требованиями и правилами к работе с материалами, потенциаль‑
но инфицированными возбудителями II группы патогенности, их хранении и транспортировки
согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплифи‑
кации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I – IV групп
патогенности» и «Временными рекомендациями по лабораторной диагностике новой корона‑
вирусной инфекции, вызванной 2019-nCov», направленными в адрес органов исполнительной
власти субъектов Российской Федерации в сфере охраны здоровья Роспотребнадзором письмом
от 21.01.2020 № 02/706-2020-27.
Медицинский работник, выполняющий взятие диагностического материала, его марки‑
ровку и упаковку должен пройти инструктаж по санитарно-эпидемиологическим требованиям
и правилам биологической безопасности при работе с пациентами, потенциально инфициро‑
ванными микроорганизмами II группы патогенности. Биологический материал (мазки из носо‑
глотки, ротоглотки, моча, фекалии) может быть отобран самостоятельно пациентом согласно
инструкции. отрудники, осуществляющие взятие диагностического материала, должны быть
обеспечены средствами индивидуальной защиты: респираторы типа FFP2 или их эквивалент,
или пневмощлем, обеспечивающий более высокий уровень защиты; очки для защиты глаз или
защитный экран; противочумный костюм, одноразовые латексные (резиновые) перчатки; водо‑
непроницаемый фартук.
Мазок из носоглотки или ротоглотки (зева) берется стерильным тампоном, который, после
взятия материала помещается в стерильную пластиковую пробирку с транспортной средой
(с учетом рекомендаций производителя применяемых тест-систем/наборов реагентов). Для
повышения концентрации вируса носоглоточные и орофарингеальные мазки должны быть
помещены в одну пробирку. Температура при транспортировке должна быть +2 - +8 °C. Время
хранения образцов до исследования не должна превышать 5 дней при +2 - +8 °C., может быть
больше при –20 °C или –70 °C.
Мокрота собирается в одноразовый стерильный пластиковый контейнер объемом – 30-50 мл,
герметично закрывающийся завинчивающейся пробкой. Диаметр горлышка контейнера должен
быть не менее 30 мм. Убедитесь, что собранный материал представляет собой мокроту (отде‑
ляемое нижних дыхательных путей). Транспортировка образцов может проводиться при тем‑
пературе +2 - +8 °C. Время хранения образцов до исследования не должна превышать 48 часов
дней при +2 - +8 °C. при хранении в транспортной среде, содержащей противогрибковые и ан‑
тибактериальные препараты, более – при –20 °C или –70 °C.
Эндотрахеальный аспират, аспират носоглотки или смыв из носа собирается в стерильный
одноразовый контейнер. Транспортировка образцов может проводиться при температуре
+2 - +8 °C. Время хранения образцов до исследования не должна превышать 48 часов дней
+2 - +8 °C, более – при –20 °C или –70 °C.
Бронхоальвеолярный лаваж собирается в стерильный одноразовый контейнер. Транспор‑
тировка образцов может проводиться при температуре +2 - +8 °C. Время хранения образцов
до исследования не должна превышать 48 часов при +2 - +8 °C, более – при –20 °C или –70 °C.
Ткани биопсии или аутопсии, включая легкие, помещаются в одноразовые контейнеры
с физиологическим раствором, содержащим противогрибковые и антибактериальные препара‑
ты. собирается в стерильный одноразовый контейнер). Транспортировка образцов может про‑
водиться при температуре +2 - +8 °C. Время хранения образцов до исследования не должна
превышать 24 часов при +2 - +8 °C, более – при –20 °C или –70 °C.
Для идентификации образцов контейнеры/пробирки маркируются в месте сбора с исполь‑
зованием самоклеящихся этикеток с информацией, обеспечивающей однозначную идентифи‑
кацию образца и его соответствие направлению.
Транспортировка герметично закрытых контейнеров с образцами в лабораторию осущест‑
вляется в специальных контейнерах/биксах. Направления и другая документация на бумажных
носителях передается в отдельном полиэтиленовом пакете.
При необходимости пересылки образцов в лабораторию другого медицинского учрежде‑
ния выполняются требования к пересылке инфекционных материалов II группы патогенности
(СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов
I-IV групп патогенности»).
Пробирки/контейнеры с образцами вместе с крышкой герметизируют различными пла‑
стификаторами (парафин, парафильм и др.); емкость маркируют. Образцы каждого пациента
помещают в индивидуальный герметичный пакет с адсорбирующим материалом и дополни‑
тельно упаковывают в общий герметичный пакет.
Два или более образца одного пациента могут быть упакованы в один пластиковый пакет.
Запрещается упаковывать образцы клинического материала от разных людей в одну упаковку.
Пакет с контейнерами помещают в герметично закрывающийся контейнер для транспор‑
тировки биологических материалов. Контейнер помещают в пенопластовый термоконтейнер
с охлаждающими термоэлементами. Транспортный контейнер опечатывается и маркируется.
В контейнер желательно поместить одноразовый индикатор, контролирующий соблюдение
температуры от 2 до 8 °C
Сопроводительные документы помещаются в индивидуальную упаковку отдельно от био‑
логического материала и прочно прикрепляются снаружи контейнера.
Направление на исследование для этиологической диагностики COVID‑19
Направление на лабораторное исследование оформляется в электронном виде (через си‑
стему удаленной электронной регистрации, или в виде электронного заказа в программе МИС
врачом-клиницистом), или на бумажном носителе.
Направление на лабораторное исследование должно содержать:
– персональные данные пациента, обеспечивающие
его однозначную идентификацию;
– наименование направившего биоматериал отделения (организации);
– предварительный диагноз заболевания: «пневмония» или «ОРВИ» или «обследование
контактировавших лиц на SARS-CoV‑2»;
– указание вида диагностического материала;
– дату и время назначения лабораторного исследования;
– дату и время взятия материала;
– фамилию, имя, отчество (при наличии) и должности врача либо другого уполномочен‑
ного представителя, назначившего лабораторное исследование.
– фамилию, имя, отчество (при наличии) медицинского работника, осуществившего взя‑
тие биоматериала.
При направлении диагностических материалов для исследования в лабораторию другой
медицинской организации, помимо сведений, перечисленных выше, должно быть указано наи‑
менование медицинской организации, в которую направляется диагностический материал.
В направлениях образцов пациентов с респираторными симптомами, прибывших из стран
с зарегистрированными случаями COVID‑19, или относящихся к группам риска, должно быть
отмечено «cito». Эти образцы должны направляться в лабораторию и исследоваться в приори‑
тетном порядке.
Передача образцов диагностических материалов от пациентов с подозрением на COVID‑19
проводится с предоставлением направлений и оформлением Акта приема-передачи, в котором
должны содержаться:
• наименование направившего на исследование образцы медицинского учреждения/отде‑
ла/подразделения,
• наименование принявшего на исследование образцы медицинского учреждения/отдела/
подразделения,
• дата передачи образцов,
• фамилия, имя, отчество и подпись передавшего образцы сотрудника,
• фамилия, имя, отчество и подпись принявшего образцы сотрудника,
• перечень передаваемых образцов (с обозначением образцов, направленных на исследо‑
вание «cito», и их количество.
Акт оформляется в двух экземплярах, один для направившей организации, другой для
принявшей образцы организации.
Сроки выполнения исследования
Время представления заключения по результатам исследования при получении отрица‑
тельных, сомнительных или положительных результатов, не должно превышать 48 часов с мо‑
мента поступления образца биологического материала в лабораторию, за исключением случа‑
ев выбраковки образцов. При назначении исследования “cito” результат должен быть
предоставлен в течении нескольких часов, в зависимости от применяемых тест-систем/наборов
реагентов.
Требования к помещениям и оснащению лабораторий, проводящих исследования
для специфической лабораторной (этиологической) диагностики COVID‑19
Лабораторные исследования для обнаружения возбудителя COVID‑19, отнесенного ко II
группе патогенности должны проводится с соблюдением санитарно-эпидемиологических пра‑
вил СП 1.3.3118-13 «Безопасность работы с микроорганизмами I – II групп патогенности (опас‑
ности)», а также, при использовании молекулярно-генетических методов (без накопления
возбудителя), в лабораториях, имеющих санитарно-эпидемиологическое заключение о возмож‑
ности проведения работ с микроорганизмами III группы патогенности (п. 2.1.6. СП 1.3.3118-13
«Безопасность работы с микроорганизмами I – II групп патогенности (опасности)») в соответ‑
ствии с требованиями СП 1.3.2518-09 (1.3.2322-08) «Безопасность работы с микроорганизмами
III – IV групп патогенности (опасности) и возбудителями паразитарных болезней».
Требования к помещению и оборудованию при проведении специфической лабораторной
(этиологической) диагностики COVID‑1 соответствуют вышеприведенным санитарным
правилам и правилам, изложенным в МУ 1.3.2569-09 «Организация работы лабораторий, ис‑
пользующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим
микроорганизмы I-IV групп патогенности». Для предотвращения перекрестной контаминации
образцов амплифицированными продуктами, рабочие зоны для выделение РНК и для проведе‑
ния МАНК с обратной транскрипцией и учета ее результатов при использовании гибридизаци‑
онно-флуоресцентного метода детекции должны быть расположены в отдельных помещениях,
удаленных друг от друга.
Лаборатория должна иметь оборудование, достаточное для проведениия МАНК для диа‑
гностики COVID‑19, с учетом применяемых методов и объема работы.
Лаборатория должна иметь средства индивидуальной защиты – СИЗ (одноразовая защит‑
ный костюм IV типа, маски, респираторы, защитные очки, одноразовые латексные (резиновые)
перчатки и др.) в достаточных количествах в соответствии с СП 1.3.3118-13, включающих не‑
обходимое количество комплектов для каждой рабочей зоны, возможность смены СИЗ в течении
дня, запас СИЗ, обеспечивающий бсперебойное обеспечение персонала необходимыми СИЗ.
Лабораторные этапы специфической лабораторной (этиологической) диагностики
COVID‑19
На этапе приёма, сортировки и регистрации материала лаборатория должна проводить
выбраковку образцов, для которых информация в направлении не совпадает с данными на эти‑
кетке или в Аке передачи, нарушены сроки и правила транспортировки, нарушена герметичность
контейнеров. Лаборатория обязана сообщить в медицинское учреждение/отделение или напра‑
вившему образцы врачу о выбраковке образцов и ее причине.
Для проведения МАНК лаборатории применяют зарегистрированные в Российской Фе‑
дерации как изделия медицинского назначения тест-системы/реагенты. Специалисты лабора‑
тории должны владеть МАНК.
При получении положительного результата на COVID‑2019 необходимо незамедлительно
информировать территориальные органы Роспотребнадзора в субъектах Российской Федерации
и направлять биологический материал в федеральные бюджетные учреждения здравоохране‑
ния – центры гигиены и эпидемиологии в субъектах Российской Федерации.
Дезинфекция, обращение с отходами при проведении специфической лабораторной
(этиологической) диагностики COVID‑19
В лаборатории проводится периодическая обработка помещений с применением бакте‑
рицидных УФ‑излучателей (Руководство Р3.5.1904-04 «Использование ультрафиолетового
бактерицидного излучения для обеззараживания воздуха в помещениях») и дезинфицирующих
средств, в соответствии с СП 1.3.2518-09 (1.3.2322-08). Обработка помещений проводится
по окончанию работы
При проведении исследований образуются отходы, относящиеся к классам А, Б, В и Г
(СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицин‑
скими отходами»)
Все использованные одноразовые материалы и другие отходы подвергаются обработке
дезинфицирующими средствами и последующей утилизации в соответствии с СанПин 2.1.7.2527-
09 (2.1.7.728-99) «Правила сбора, хранения и удаления отходов лечебно-профилактических
учреждений» и МУ 287-113 «Методические указания по дезинфекции, предстерилизационной
очистке и стерилизации изделий медицинского назначения».
Приложение 4.
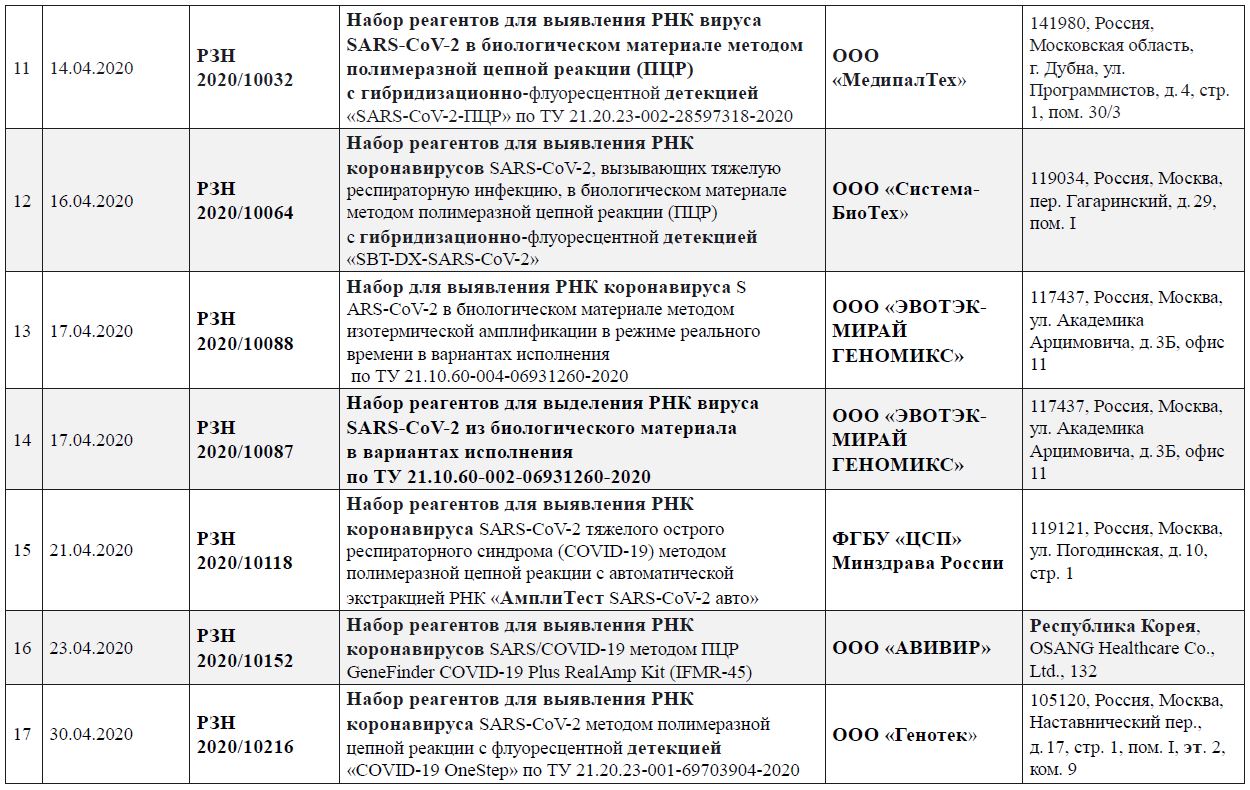
Перечень зарегистрированных в Российской Федерации диагностических наборов реагентов для выявления РНК SARS-CoV‑2
(по состоянию на 26.05.2020)
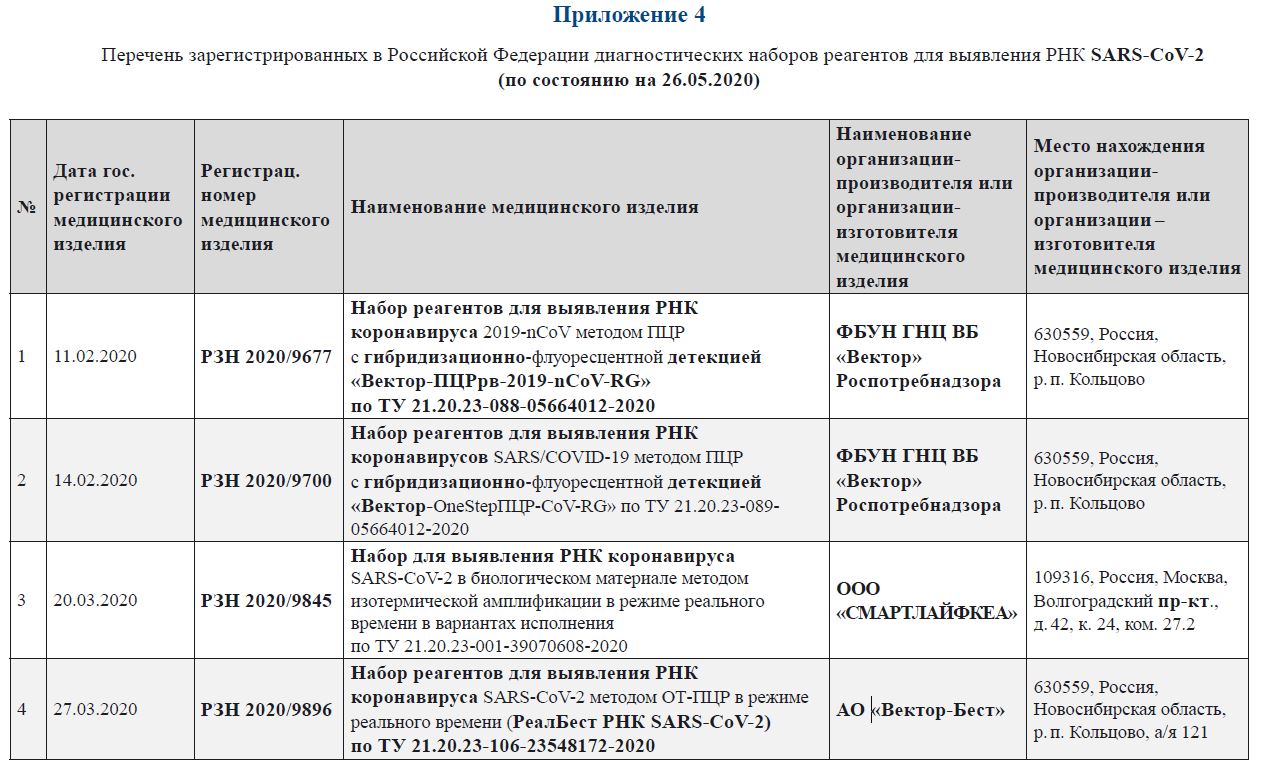
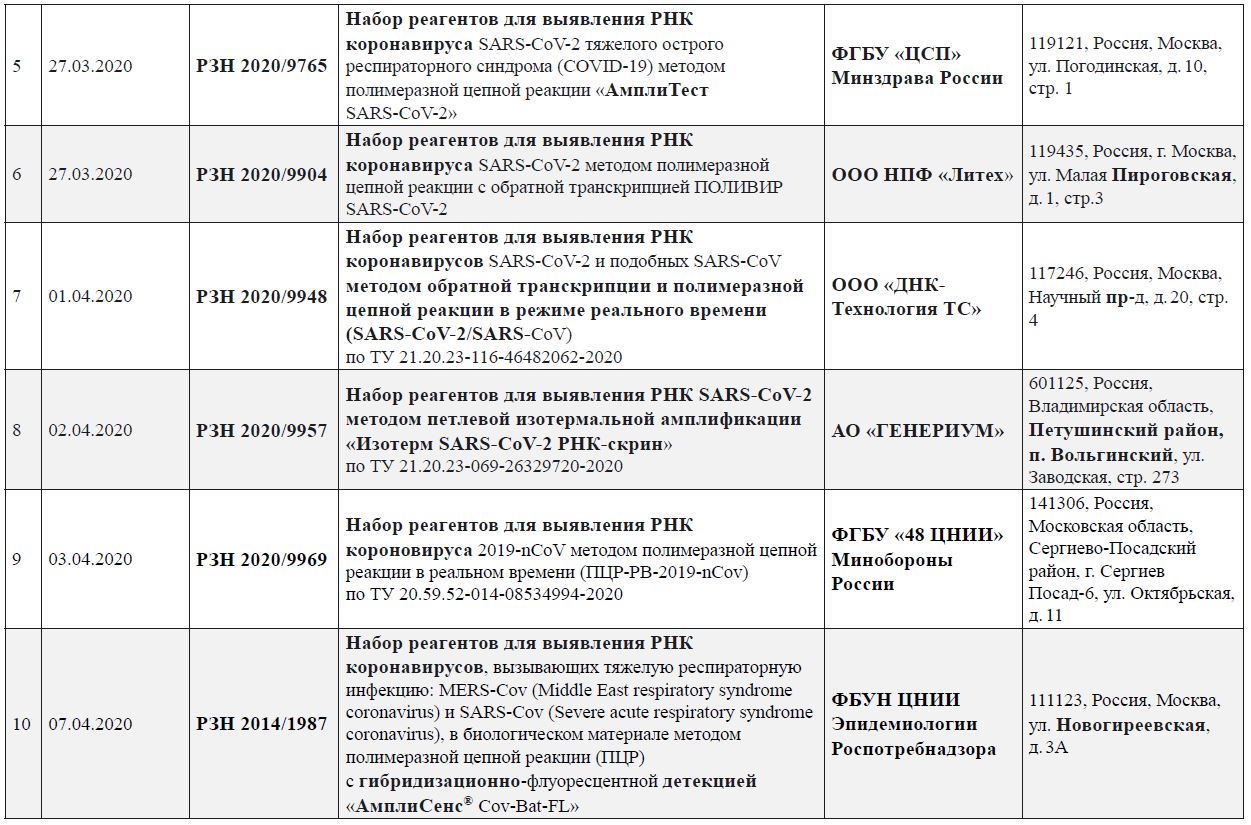

Приложение 5-1.
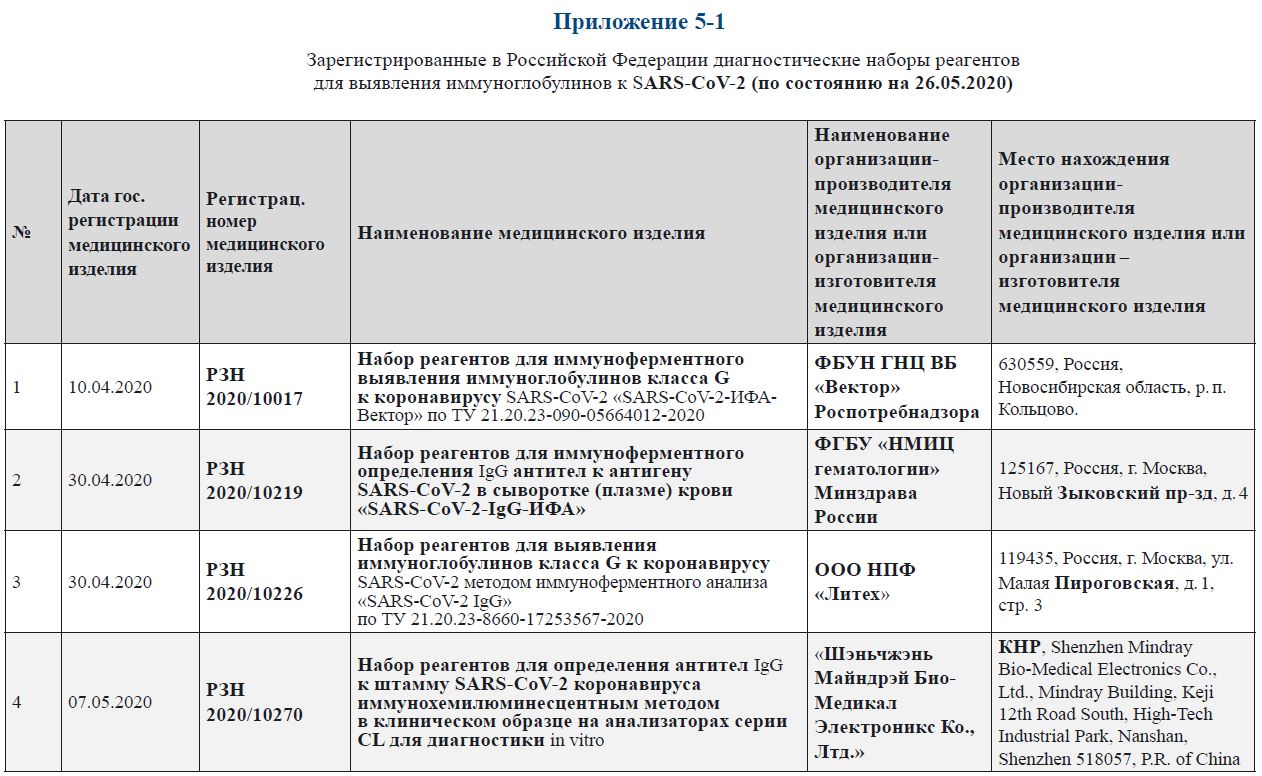
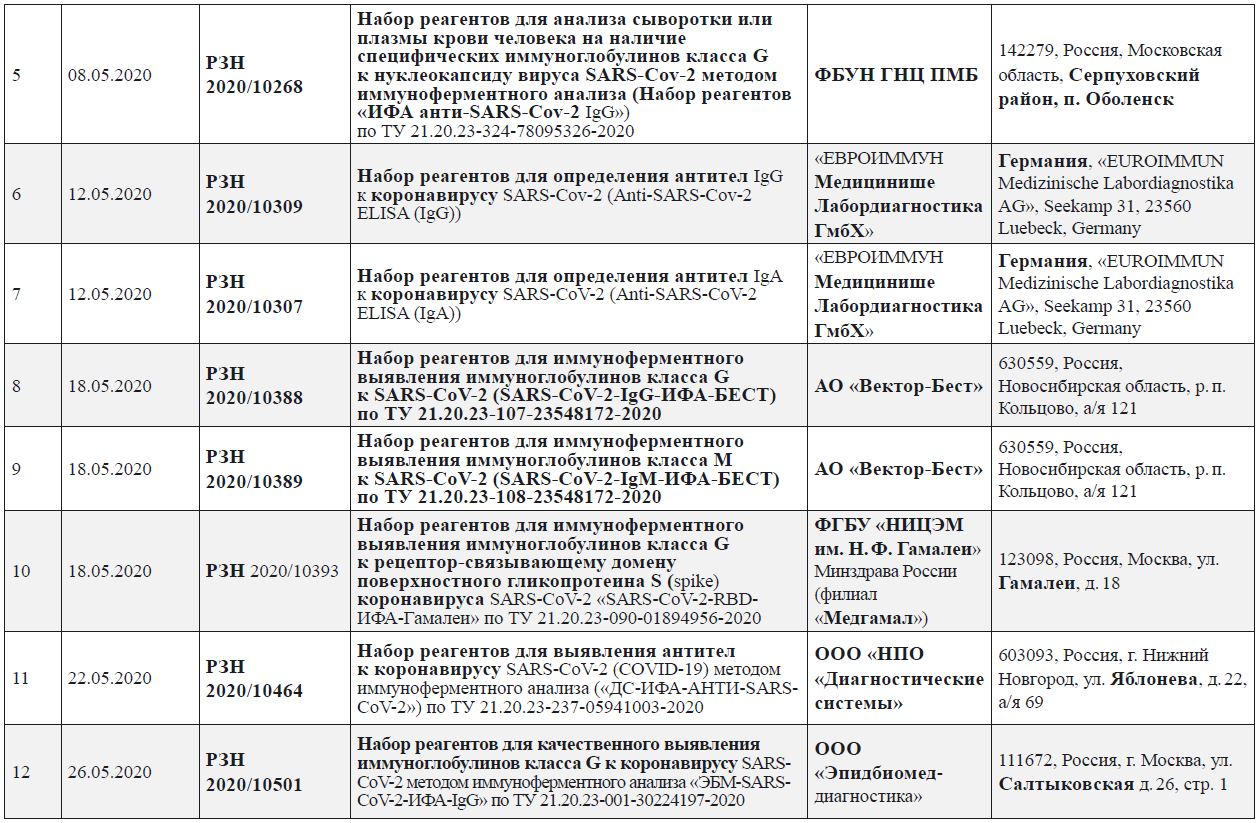
Зарегистрированные в Российской Федерации диагностические наборы реагентов для выявления иммуноглобулинов к SARS-CoV‑2 (по состоянию на 26.05.2020)
Приложение 5-2
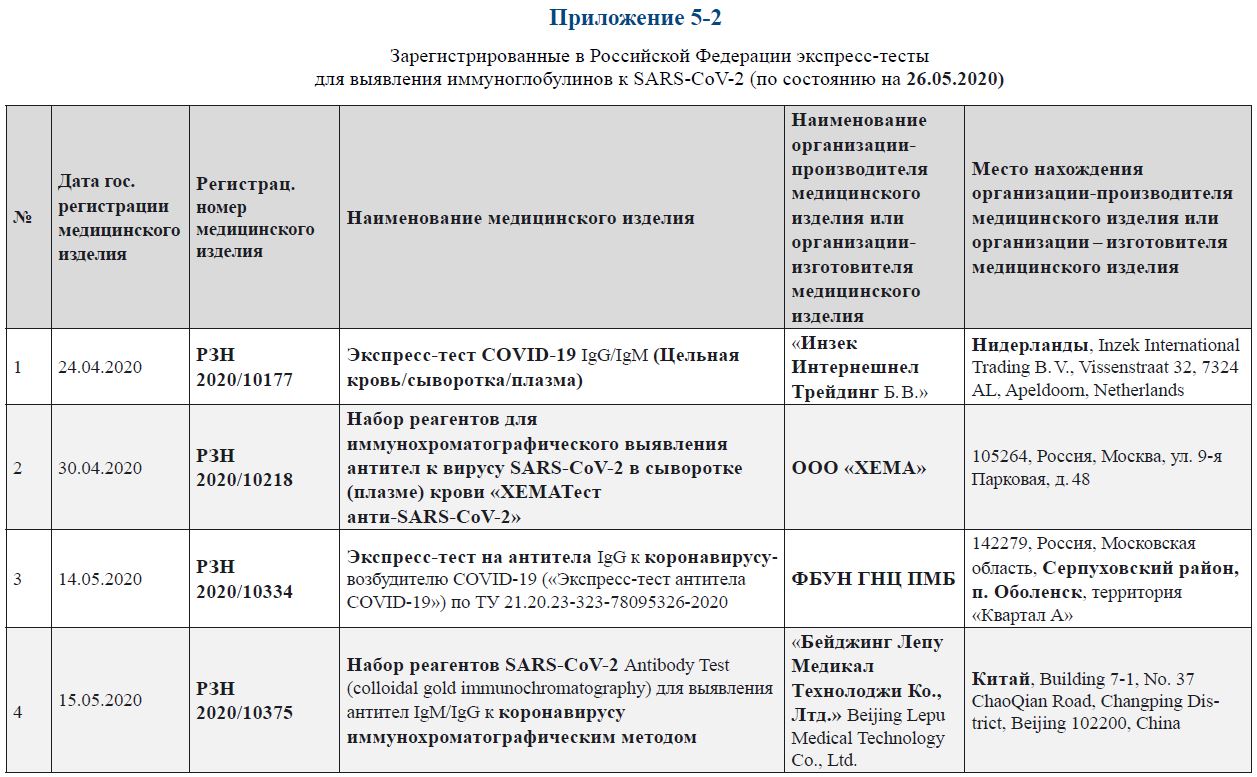
Зарегистрированные в Российской Федерации экспресс-тесты для выявления иммуноглобулинов к SARS-CoV‑2 (по состоянию на 26.05.2020)




Комментарии (0)
Зарегистрируйтесь, чтобы добавить комментарий