Болезнь Лайма - это мультисистемное заболевание, вызываемое главным образом Borrelia burgdorferi sensu lato. Однако, B. garinii, который был идентифицирован на островах у побережья Ньюфаундленда и Лабрадора, Канада, является причиной болезни Лайма в Евразии. Авторы статьи сообщают о выделении и нуклеотидном секвенировании всего генома B. garinii изолята хлопковой мыши (Peromyscus gossypinus) в Южной Каролине, США. Авторы идентифицировали второй изолят B. garinii из того же хранилища. Филогенетический анализ не связывает эти изоляты с ранее описанными изолятами B. garinii из Канады.
Введение
Болезнь Лайма - это мультисистемное заболевание, вызываемое заражением бактериями комплекса видов Borrelia burgdorferi sensu lato. Три представителя этого комплекса, B. burgdorferi в строгом смысле, B. garinii и B. afzelii, ответственны за большинство случаев болезни Лайма во всем мире.[1,2] B. burgdorferi s.l. является единственным из этих 3 видов, который широко распространен в Северной Америке, хотя B. garinii был идентифицирован на островах у побережья Ньюфаундленда и Лабрадора, Канада .[3-5]
Авторы описывают выделение и характеристику секвенирования генома изолята из Южной Каролины B. garinii из хранилища штаммов от хозяев-грызунов и переносчиков клещей на юго-востоке Соединенных Штатов, который был идентифицирован как B. burgdorferi s.l. Второй изолят B. garinii из того же хранилища штаммов B. burgdorferi s.l. был идентифицирован на основе мультилокусного типирования последовательности (MLST). Филогенетический анализ показал, что эти 2 штамма из юго-восточной части Соединенных Штатов были наиболее тесно связаны с группой B.Изоляты garinii из Европы, но не были получены от штаммов из Канады или наоборот.[3]
Методы
Источники, культивирование и анализы Borrelia spp.
2 описанных изолята Borrelia были выделены из образцов биопсии уха хлопковой мыши (Peromyscus gossypinus) (SCCH-7), пойманной в округе Чарльстон, Южная Каролина, в 1995 году, и из восточной лесной крысы (Neotoma floridana) (SCGH-19), пойманной в округе Джорджтаун, Южная Каролина, в 1996 году (Приложение, https://wwwnc.cdc.gov/EID/article/29/1/22-0930-App1.pdf).[6] Авторы проводили культивирование боррелий в среде Barbour-Stoenner-Kelly H, очистку ДНК и ПЦР-анализы, как описано.[7] Авторы обнаружили B. burgdorferi s.l. в образцах путем амплификации межгенной области 5S-23S[8] (Приложение) с использованием видоспецифичной ПЦР и праймеров, разработанных на основе гена OspA, что подтвердило наличие множества видов спирохет.[9] Культуры, в которых был подтвержден B. garinii, высевали на твердую среду, и выделяли клональные единичные колонии в соответствии с модифицированным протоколом[10] (Приложение).
Полногеномное секвенирование и сборка генома
Авторы выполнили полногеномное секвенирование с использованием системы Pacific Biosciences Sequel II (https://www.pacb.com). Авторы выполнили сборку генома с помощью инструмента сборки генома в PacBio SMRTLink версии 10.2 и 150 Мб чтения в формате Hi-Fi >5 кб (Приложение).
Порядковые номера нуклеотидных последовательностей
Последовательности были депонированы в GenBank. Геномная сборка SCCH-7 была депонирована в GenBank в рамках BioProject PRJNA431102 и регистрационный номер биопробы. SAMN26226110 (Приложение). Нуклеотидные последовательности 8 генов домашнего хозяйства (ClpA, ClpX, nifS, pepX, pyrG, RecG, rplB и uvrA) SCCH-7 и SCGT-19 были депонированы в GenBank под регистрационными номерами. KP795353–60 (SCCH-7) и KT285873–80 (SCGT-19). Последовательности MLST также были внесены в базу данных PubMLST (https://pubmlst.org ) под номерами аллелей, присвоенных уникальным локусам (SCCH-7, аллель № 272 ClpX и Аллель № 278 uvrA; SCGT-19, аллель № 311 ClpA и аллель № 273 гена ClpX). Уникальные номера типа последовательности (ST) в базе данных PubMLST - 1049 для SCCH-7 и 1050 для SCGT-19.
Анализ последовательности
Авторы выполнили MLST-анализ 8 генов домашнего хозяйства (ClpA, ClpX, nifS, pepX, pyrG, RecG, rplB и uvrA) обоих изолятов (SCCH-7 и SCGT-19) и полногеномное секвенирование штамма SCCH-7 на ДНК, выделенной на пассаже 6, как описано.[11] Максимально вероятная филогения штаммов B. garinii на основе объединенного набора данных из 8 последовательностей локусов домашнего хозяйства (всего 184 изолята, 4791 нтл) была выведена в RAxML (https://raxml-ng.vital-it.ch ) в соответствии с обобщенной моделью, обратимой во времени плюс Γ4 (Приложение). Авторы выполнили филогеографический анализ распространения в дискретном пространстве, как реализовано в BEAST[12] в соответствии с предыдущим коалесцентным деревом постоянного размера и моделью симметричной замены с принудительным выбором переменной байесовского стохастического поиска (Приложение). Чтобы сравнить последовательности для всей хромосомы, исследователи выровняли хромосомную последовательность SCCH-7 с 2 опубликованными хромосомными последовательностями штамма 20047 с помощью NUCMER.[13] Авторы вывели филогенетическое дерево с помощью IQTREE[14] с параметрами по умолчанию из выравнивания MLST 34 изолятов B. garinii, наиболее тесно связанных с 2 изолятами из Соединенных Штатов.
Результаты
B. Garinii от грызунов в Южной Каролине
2 изоляты B. garinii, о которых Авторы сообщают, были получены из образцов биопсии уха хлопковой мыши (Peromyscus gossypinus) (изолят SCCH-7) и восточной лесной крысы (Neotoma floridana) (изолят SCGT-19); оба были пойманы в Южной Каролине.[6] Эти культуры были частью коллекции на юго-востоке Соединенных Штатов, насчитывающей около 300 изолятов Borrelia, которые были получены в 1991-1999 годах в Миссури, Джорджии, Флориде, Техасе и Южной Каролине и размещались в Институте артроподологии и паразитологии Джеймса Х. Оливера-младшего при Южном университете Джорджии (Стейтсборо, Джорджия, США). Множественные О видах Borrelia в многочисленных культурах этой коллекции, часто присутствующих в качестве сопутствующих инфекций, сообщалось в более ранних исследованиях, включая B. andersonii,[15-18]B. burgdorferi s.s.,[6,15,19]B. bissettiae,[15-18]B. carolinensis,[7, 20]Б. americana,[21] и ранее неописанный изолят из Техаса, TXW-1.[16-18]
Авторы подтвердили B. burgdorferi s.l. в культурах путем ПЦР-амплификации общей ДНК с набором праймеров 5S-23S рРНК.[8] Авторы идентифицировали присутствующий вид B. burgdorferi s.l. путем клонирования общих продуктов ПЦР в вектор pCR4-TOPO TA и секвенирования отдельных рекомбинантов. Авторы наблюдали последовательности с высоким сходством с B. garinii из 5 культур. Затем исследователи поместили эти культуры на твердую среду для получения отдельных колоний и выбрали чистые клональные культуры B. garinii SCCH-7 клон 138 и SCGT-19 клон 19 из 2 культур для дальнейшего изучения.
Цельногеномная последовательность изолята SCCH-7 B. Garinii для Borrelia Garinii
Авторы определили полногеномную последовательность изолята SCCH-7 с помощью одномолекулярных методов PacBio в реальном времени (Приложение). Подобно другим геномам B. burgdorferi sensu lato,[22-24] геном SCCH-7 содержит линейную хромосому и несколько линейных плазмид (lp) и кольцевых (cp) плазмид. SCCH-7 несет lp17, lp28–7, lp32–10, lp36 и lp54, а также cp26, cp32–3 и cp32–6.[25] Плазмидные последовательности SCCH-7 типичны для известных геномов B. garinii и сходны с таковыми у штамма 20047 B. garinii, хотя штамм 20047 несет плазмиду lp28–4, которой не хватает в SCCH-7. Геном SCCH-7 составляет 1 161 212 п.н. (хромосома 906 106 п.н., линейные плазмиды 168 083 п.н. и кольцевые плазмиды 87 023 п.н.). Поскольку линейные хромосомные и плазмидные последовательности включают все теломеры, этот геном объединяет геномы B. burgdorferi B31 и B. mayonii MN14–1539 и является действительно полным.[26-28] Хромосома SCCH-7 отличается от хромосомы штамма 20047 B. garinii всего 2 однонуклеотидными вариациями (SNV) и 2 короткими вставками/делециями из последовательности в присоединении №. CP028861 и 8 SNV и 4 коротких фрагмента из последовательности в CP018744 (эти 2 хромосомные последовательности 20047 были получены 2 независимыми исследовательскими группами, S. Bontemps-Gallo и G. Margos, Bioproject PRJNA224116). Плазмиды 20047 были кратко описаны Casjens et al.[24] Эта цельногеномная последовательность однозначно демонстрирует, что SCCH-7 является изолятом B. garinii.
Филогенетический анализ
Ранее сообщалось об изолятахB. garinii из Северной Америки на прибрежных островах Атлантического океана в восточной части Канады.[3-5,29] Чтобы выяснить, могли ли изоляты Южной Каролины происходить с этих островов в Канаде или наоборот, и для выяснения взаимосвязи SCCH-7 и SCGT-19 с другими изолятами B. garinii, авторы амплифицировали с помощью ПЦР и определили последовательности SCGT-19 для 8 генов (Приложение), которые использовались ранее. в MLST-анализах изолятов B. burgdorferi sensu lato. Затем авторы извлекли эти последовательности из последовательностей всего генома SCCH-7 и 20047.
Авторы составили филогенетическое дерево (приложение Рисунок 1) данных MLST по изолятам в этой ветви вида B. burgdorferi s.l. и дерево максимального правдоподобия (RAxML) последовательностей MLST, которое включает изоляты SCCH-7 и SCGT-19 и 178 других изолятов, доступных из близкородственных видов B. garinii и B. bavariensis, а также 5 изолятов B. turdi в качестве примера. внешняя группа (Таблица приложения 1). Помимо 1 необычного изолята из Европейской части России (pubMLST ID: 2488 Om16-103-Iapr), который является сестринской ветвью для всех других изолятов, остальные 178 изолятов образуют 2 клады, которые согласуются с ранее определенными видами B. bavariensis (39 изолятов) и B. garinii (139 изолятов) (рисунок).[30] Группа B. bavariensis содержит 4 изолята из Европы и 1 изолят из Канады, вкрапленных среди большинства изолятов из Азии, что позволяет предположить, на основе максимальной экономии, что эта группа является предковой кладой из Азии, которая имела несколько независимых интрогрессий в Европу.[31]
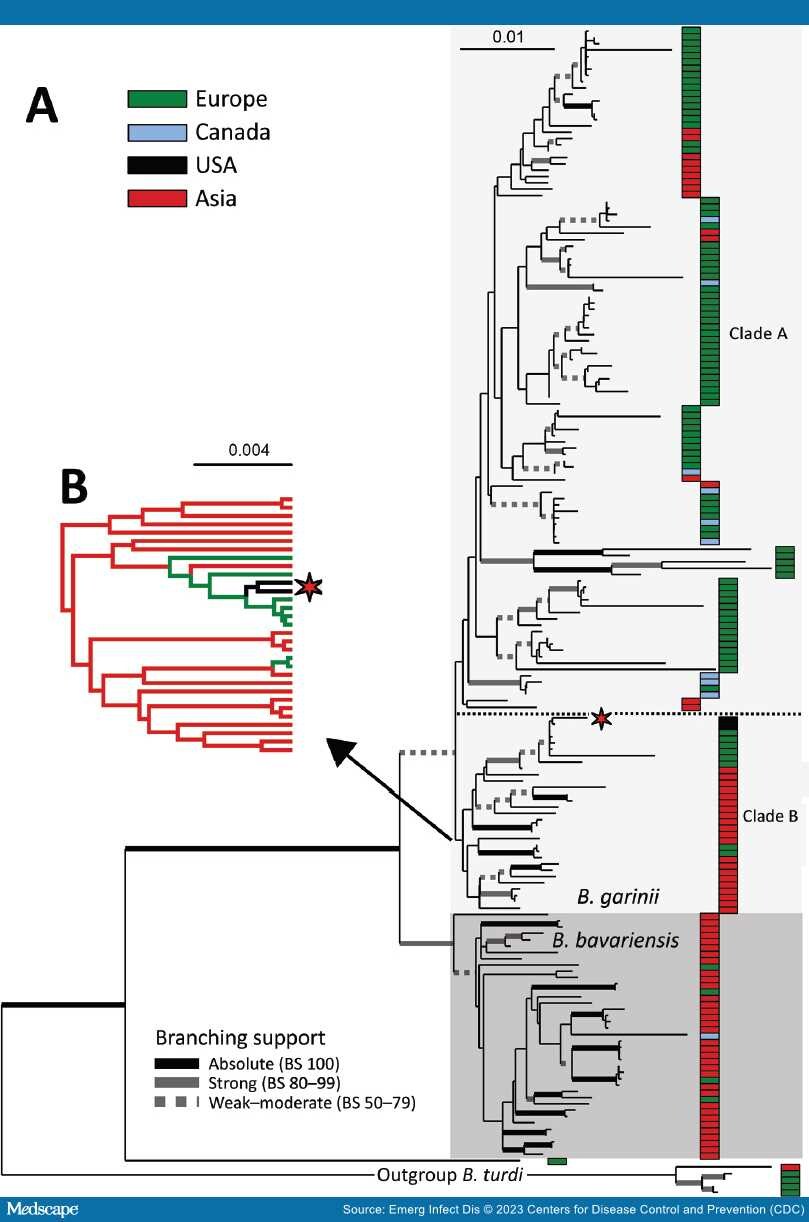
Рисунок.
Филогения с максимальной вероятностью Borrelia garinii/B. bavariensis. А) Филогения с максимальной вероятностью B. garinii/B. bavariensis, происходящая от B. turdi. Топология основана на анализе секционированного набора данных из 8 локусов генотипирования с мультилокусным последовательным типированием) в рамках обобщенной обратимой во времени модели плюс Γ4 (для каждого раздела) в RAxML 8 (https://cme.h-its.org/exelixis/web/software/raxml ). Окончательное выравнивание включает 184 таксона и 4791 нт позиций. Утолщенные ветви указывают на поддержку ветвления, оцененную с помощью непараметрического бутстрап-анализа на основе 1000 повторов в RAxML 8. Для лучшей читаемости поддержка классифицирована в соответствии со схемой, показанной внизу дерева. Изоляты были сгруппированы по 7 категориям в соответствии с их географическим происхождением, которое имеет цветовую маркировку в соответствии со схемой в верхней правой части дерева на топологии. Положение 2 американских изолятов обозначено звездочкой. Б) Набор результатов филогеографического анализа распространения на дискретном пространстве, показывающий предполагаемое географическое происхождение внутренних ветвей для предковой клады B. garinii из Азии. Полная топология показана на рисунке 2 приложения, панель B (https://wwwnc.cdc.gov/EID/article/29/1/22-0390-App1.pdf ), и полная информация об использованных методах представлена в Приложении. Линейки шкалы указывают нуклеотидные замены на сайт. BS, поддержка ветвления.
Клада B. garinii разделена на 2 основные клады. Более крупная из них (клада А, 108 изолятов) включает 76 изолятов из Европы, 13 из континентальной Азии, 2 из Японии, 9 из Канады (Ньюфаундленд и Лабрадор) и 8 из Исландии, которые в основном распространены в пределах этой ветви без видимой кластеризации по географическому происхождению. Меньшая по размерам группа B. garinii (группа B, 31 изолят) содержит 21 изолят из континентальной Азии и Японии, 8 из Европы и 2 описанных здесь из Соединенных Штатов. 2 изолята из Соединенных Штатов образуют вложенный субклад с 5 штаммами европейского происхождения в кладе B (рисунок, панель B). Кроме того, B. garinii из Канады являются членами клады А (рисунок) и не являются тесно связанными с изолятами Соединенных Штатов.
Чтобы пролить больше света на возможное происхождение 2 изолятов из Соединенных Штатов и эволюционную историю B. garinii в целом, авторы провели филогеографический анализ распространения в дискретном пространстве, как реализовано в BEAST (Приложение). Этот байесовский метод позволяет определить предковое состояние в каждом узле данного дискретного признака (в данном случае, географическое происхождение штамма). Результирующая древовидная топология (рис. 2 приложения, панель А), как показано в результате слияния (https://www2.unil.ch/popgen/softwares/quantinemo/coalescence .html) модель постоянного размера, разделила изоляты на несколько групп. Предполагается, что клады B. bavariensis и B, состав которых соответствует топологии MLST (рисунок), происходят из Азии. 2 изолята из Соединенных Штатов (рисунок) относятся к кладу В и вложены в несколько последовательностей из Европы (рис. 2 приложения). Изоляты из Европы разделены на 3 клады (A1, A2 и A3), первая из которых (A1) обнаружена у основания всей части дерева B. bavariensis/B. garinii. Клада A1 состоит из 5 дивергентных B.Изоляты garinii из Словакии, отделенные от всех других изолятов из Европы и изолятов B. bavariensis. Предковая клада из Азии (клада B) (рисунок; Приложение Рисунок 2, панель A) вложена в клады A1 и A2, которые, как было предсказано, происходят из Европы. Конечное положение штаммов из Европы в предковой кладе из Азии (клада B) предполагает вторичную, более позднюю интродукцию в Европу из Азии. Таким образом, реконструкция предков по ЗВЕРЮ предполагает частые исторические и недавние события миграции видов B. bavarensis и B. garinii в пределах Евразии.
Принадлежность изолятов Соединенных Штатов к Европе и более широкой кладе предков B. garinii из Азии (клада B) последовательно присутствует в обоих деревьях (рисунок; Приложение Рисунок 2, панель A) и подтверждается филогеографической реконструкцией с использованием алгоритма байесовского стохастического поиска.[32-34] Однако из-за большого единичного числа изолятов и относительно небольшого числа филогенетически-информативных позиций (i.например, высокое сходство последовательностей), поддержка начальной загрузки внутренних ветвей была невысокой. Поэтому авторы проверили независимую эволюционную историю изолятов из Соединенных Штатов и Канады, используя приблизительно беспристрастный топологический тест.[35] Сначала авторы принудительно ограничили монофилию 2 изолятов из Соединенных Штатов с каждым из 9 изолятов из Канады; затем авторы использовали RAxML для повторной оптимизации общей топологии. Затем авторы сравнили оценки логарифмического правдоподобия этих альтернативных топологий для каждого участка с исходной топологией MLST (рисунок), используя приблизительно беспристрастный in CONSEL.[36] Полученные значения p, варьирующие от 1,48 × 10-36 до 1,9 × 10-2 (таблица 2 приложения), подтверждают отказ от общего происхождения B. garinii из Канады и Соединенных Штатов. Авторы пришли к выводу, что, в отличие от изолятов из Канады, которые могли быть завезены туда из Европы или Исландии морскими птицами и связанными с ними клещами,[37] B. garinii с юго-востока Соединенных Штатов являются частью наследственной линии из Восточной Азии, которая, возможно, попала в Соединенные Штаты из Европы.
Хромосомные связи с близкородственными геномами B. garinii
Дерево максимального правдоподобия из 32 близкородственных геномов B. garinii на основе 8 локусов домашнего хозяйства (рис. 3 приложения) показывает, что 2 изолята из Соединенных Штатов объединяются с несколькими изолятами из Европы, которые, по топологии дерева, вероятно, были связаны с предком из Азии (рис.). Авторы собрали все различия в последовательности в 8 локусах домашнего хозяйства среди штаммов, которые наиболее тесно связаны с 2 изолятами из Соединенных Штатов (таблица приложения 3). Последовательность MLST SCCH-7, полученная из генома, и 2 независимые последовательности MLST 20047, почти идентичны. Представленная последовательность MSLT 20047 года имеет 2 отличия в гене RecG по сравнению с 3 последовательностями всего генома, вероятно, вызванными ошибками секвенирования. Эти идентичные последовательности убедительно подтверждают неканадское происхождение, в частности недавнее европейское происхождение изолята SCCH-7 в Соединенных Штатах.
В отличие от SCCH-7, штамм SCGT-19 демонстрирует отличный MLST-гаплотип, определяемый 16 SNV и 1 коротким indel (Таблица приложения 3). Версии SCGT-19 некоторых из этих SNV и indel обнаружены у других штаммов B. garinii из Японии и Европы, что позволяет предположить, что они вряд ли являются ошибками при секвенировании. Кроме того, последовательные прогоны SNV в локусах ClpA и ClpX убедительно указывают на то, что их происхождение вызвано рекомбинацией, а не мутацией de novo. Различия между SCCH-7 и SCGT-19 позволяют предположить, что миграция или импорт B. garinii из Евразии в Соединенные Штаты могли состоять из нескольких штаммов исходной популяции.
Обсуждение
Наши результаты предоставляют убедительные доказательства того, что B. garinii присутствовал у грызунов в Южной Каролине, хотя его текущее состояние там неизвестно. В частности, 5 образцов, которые авторы протестировали, были положительными на B. garinii, и из 2 независимых культур B. garinii, которые авторы размножили и проанализировали, клон 138 SCCH-7 и клон 19 SCCH-19.
MLST-анализ обоих изолятов и полногеномное секвенирование SCCH-7 показали, что эти изоляты не являются тесно связанными со штаммами B. garinii из Канады; однако они тесно связаны с подмножеством евразийских изолятов. Как и когда B. garinii прибыл в Южную Каролину, остается неизвестным. Не было сообщений о вспышках болезни Лайма на юго-востоке Соединенных Штатов у людей в то время, когда штаммы были депонированы в хранилище, или в течение последующих 2 десятилетий. Это открытие сводит к минимуму необходимость немедленного нового поиска B. garinii в этом регионе. Тем не менее, клиническая бдительность в отношении B. garinii у людей в этом регионе представляется оправданной.
Благодарности
Авторы благодарят всех бывших сотрудников Института артроподологии и паразитологии Джеймса Оливера-младшего, Стейтсборо, Джорджия, за вклад в создание коллекции юго-восточных спирохет в 1991-1999 годах, а также Сяохуа Ян за ее вклад в культивирование микробов.
Это исследование было частично поддержано грантами AI110820 (C.M.F.) и AI139782 (W.Q.) Национального института аллергии и инфекционных заболеваний, Национальные институты здравоохранения; грантами NV-19-05-00191 от Министерства здравоохранения Чешской Республики (N.R и M.G.) и 21-26209s от Чешского грантового агентства (A.H.); Института паразитологии, Биологического центра Чешской академии наук (N.R., M.G., A.H. и L.G.); Института геномных наук (C.M.F. и E.F.M.), Биолабораторий Новой Англии (R.G.M.); и Фонда Стивена и Александры Коэн и Глобального альянса Лайма (B.J.L.).
Новые инфекционные заболевания. 2023;29(1):64-69. © 2023 Центры по контролю и профилактике заболеваний (CDC)

.jpg)

Комментарии (0)
Зарегистрируйтесь, чтобы добавить комментарий